創制一批對重大疾病具有較好治療作用,具有自主知識產權的藥物,從而降低對國外新藥的依賴,這對我國建設創新型國家來說,意義重大。在全力打造新醫藥與生命健康產業地標的大背景下,近年來,江北新區圍繞“基因之城”建設,聚焦打造了千億級生命健康產業集群,提前布局、著力建設以基因與細胞技術為核心的醫藥研發新高地。
數據顯示,截至目前,新區生物醫藥谷有20家企業,共計49個項目處于臨床前IND申請或臨床試驗階段。近期,又有兩家企業傳來創新藥物好消息:

1、兩款1類創新藥亮相
近日,國家“十三五”科技創新成就展在北京展覽館舉辦。江北新區企業先聲藥業自主研發的兩款1類創新藥“先必新”“艾得辛”同步亮相本次展覽。
本次展覽以“創新驅動發展邁向科技強國”為主題,共分總序、百年回望、基礎研究、高新技術、重大專項、農業科技、社會發展等12個展區。通過1300多件實物、200多件模型等,集中展示了“十三五”以來的重大科技創新成就。
作為“重大新藥創制領域“的醫藥企業之一,先聲藥業在創新藥領域不斷發力,以開放創新,打造國際水準的自主創新藥物作為企業發展的動力之源。
先必新,兩次獲得重大新藥創制專項支持
先必新:依達拉奉右莰醇注射用濃溶液
國家一類新藥,通過抑制氧化應激損傷和炎癥損傷雙重機制,改善腦卒中患者神經功能。擁有8項發明專利,核心專利在美、日、歐等多個國家及地區獲得授權;獲國家科技部“重大新藥創制”專項支持及“十三五中國醫藥科技標志性成果”等榮譽。
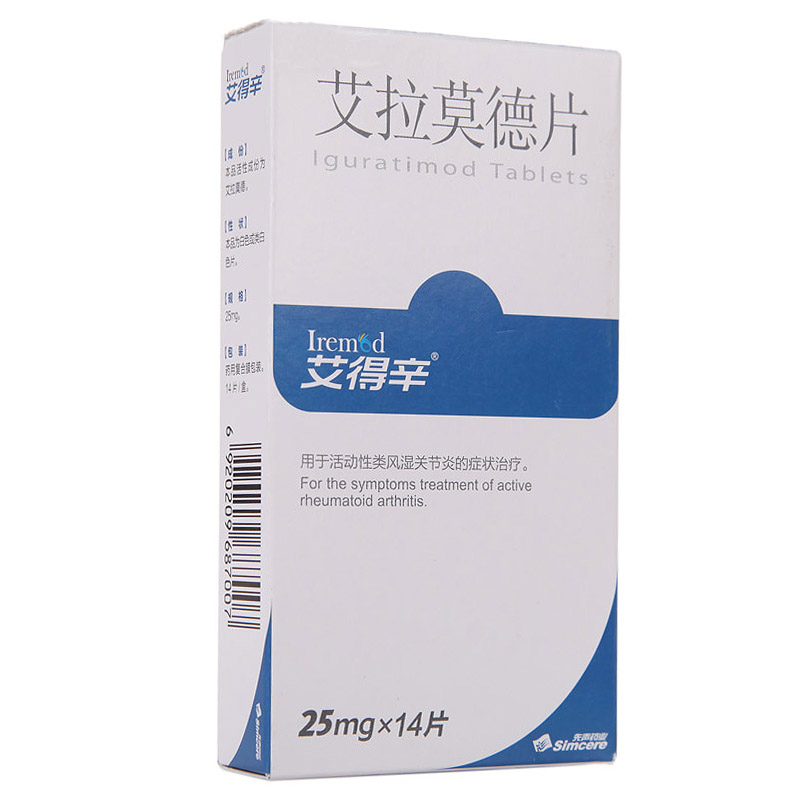
艾得辛:艾拉莫德片
艾得辛是全球首個上市和國內唯一上市的艾拉莫德藥物,也是近十年唯一上市的中國自主研發的小分子DMARDs(改善病情抗風濕藥物),已被國內外多項臨床實踐指南和診療規范推薦為活動性類風濕關節炎、原發性干燥綜合征的主要治療藥物。
2、新獲美國FDA快速通道資格
近日,江北新區企業藥捷安康(南京)科技股份有限公司宣布,美國食品藥品監督管理局(“FDA”)已授予公司核心產品TT-00420快速通道資格(FastTrackDesignation)認定,用于治療沒有標準治療選擇的膽管癌(Cholangiocarcinoma,下稱“CCA”)患者。
快速通道資格(FastTrackDesignation)是美國FDA加速藥物審評的政策之一,旨在加速治療嚴重或致命疾病的藥品研發,滿足未竟醫療需求。TT-00420獲此資格,意味著FDA認可TT-00420在早期臨床試驗中顯示出的滿足未竟醫療需求的潛力。同時,公司可以和FDA進行更有效的溝通交流,獲得FDA更多和更深入的指導,以加快產品的研發上市進程。
TT-00420是一款處于II期臨床階段的小分子創新化合物。該產品通過獨特的機制解決在膽管癌領域高度未滿足的臨床需求:
a)靶向FGFR獲得性耐藥突變和原發性耐藥突變的膽管癌;
b)獨特多激酶抑制劑協同作用針對高度異質性包括無明確基因突變的膽管癌。
TT-00420在I期臨床研究中展現了良好的安全性,目前已經在全球開展了多項腫瘤臨床試驗,試驗中心包括MDAndersonCancerCenter、中國醫學科學院腫瘤醫院等。該產品有望實現其首個適應癥率先在美國上市,其他適應癥包括三陰乳腺癌(“TNBC”)、膽道系統癌癥(“BTC”)、其他實體瘤等,也會按照計劃同期推進臨床試驗和注冊申報。
此前,TT-00420在2019年獲得了FDA授予的治療CCA的孤兒藥認證(OrphanDrugDesignation)。藥捷安康將會秉持“以醫藥,攜安康”的理念,繼續拓展戰略視野,以用小分子手段持續解決全球尚未滿足的臨床需求為使命。