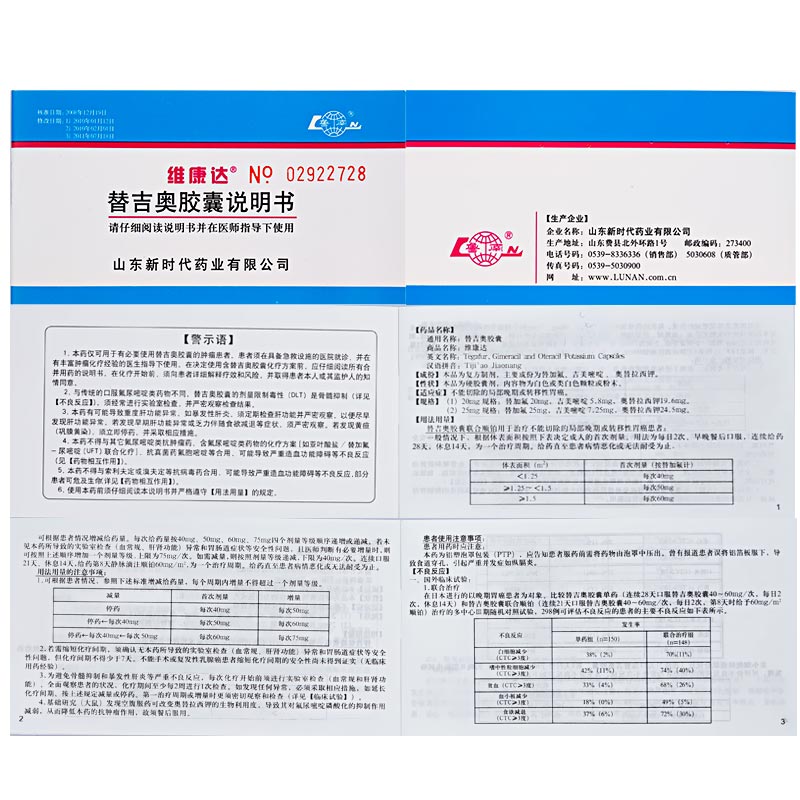
內容
介紹
替吉奧膠囊副作用一般包含1. 國外臨床試驗:
聯合治療
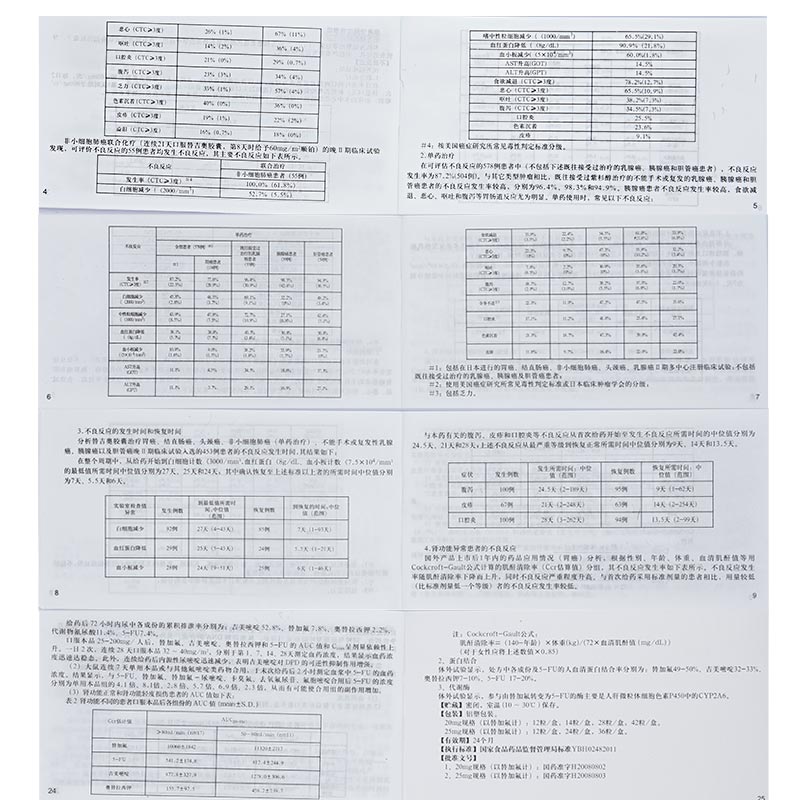
在日本進行的以晚期胃癌患者為對象、比較替吉奧腔囊單藥(連續28天口服替吉奧膠囊40-60mg/次,每日2次,休息14天)和替吉奧膠囊聯合順鉑(連續21天口服替吉奧膠囊40-60mg/次,每日2次,第8天時給予60mg/m2順鉑)治療的多中心Ⅲ期隨機對照試驗,298例可評估不良反應的患者的主要不良反應如下表所示。
非小細胞肺癌聯合化療(連續21天口服替吉奧膠囊,第8天時給予60mg/m2順鉑)的晚Ⅱ期臨床試驗發現,可評價不良反應的55例患者均發生不良反應,其主要不良反應如下表所示。
(#)4:按美國癌癥研究所常見毒性判定標準分級。
單藥治療
在可評估不良反應的578例患者中(不包括下述既往接受過治療的乳腺癌,胰腺癌和膽管癌患者),不良反應發生率為87.2%(504例)。與其它類型腫瘤相比,既住接受過紫杉醇治療的不能手術或復發的乳腺癌、乳腺癌和膽管癌患者的不良反應發生率較高,分別為96.4%、98.3%和94.9%。胰腺癌患者不良反應發生率較高,食欲減退、惡心、嘔吐和腹瀉等胃腸道反應尤為明顯。單藥使用時,常見以下不良反應:
(#1):包括在日本進行的胃癌、結直腸癌、非小細胞肺癌、頭頸癌、乳腺癌Ⅱ期多中心注冊臨床試驗,不包括既往接受過治療的乳腺癌、胰腺癌及膽管癌患者;
(#2):使用美國癌癥研究所常見毒性判定標準或日本臨床腫瘤學會的分級;
(#3):包括乏力。
不良反應的發生時間和恢復時間
分析替吉奧腔囊治療胃癌、結直腸癌、頭頸癌、非小細胞肺癌(單藥治療)、不能手術或復發性乳腺癌、胰腺癌以及膽管癌晚Ⅱ期臨床試驗入選的453例患者的不良反應發生時間,其結果如下:
在整個周期中,從給藥開始到白細胞計數3,血紅蛋白4/mm3的最低值所需時間中位值分別為27天、25天和24天;其中確認恢復至上述標準以上者的所需時間中位值分別為7天、5.5天和6天。
與本藥有關的腹瀉、皮疹和口腔炎等不良反應從首次給藥開始至發生不良反應所需時間的中位值分別為24.5天、21天和28天;上述不良反應從最嚴重等級到恢復正常所需時間中位值分別為9天、14天和13.5天。
腎功能異常患者的不良反應
國外產品上市后1年內的藥品應用情況(胃癌)分析,根據性別、年齡,體重、血清肌酐值等用Cockcroft-Gault公式計算的肌酐清除率(Ccr估算值)分組,其不良反應發生率如下表所示。不良反應發生率隨肌酐清除率下降而上升,同時不良反應嚴重程度升高。與首次給藥采用標準劑量的患者相比,用量較低(比標準劑量低一個等級)者的不良反應發生率較低。
Cockcroft-Gault公式:
男性:Ccr=(140-年齡)體重(kg)/(72血清肌酐(mg/dL))
女性:Ccr=(140-年齡)體重(kg)0.85/(72血清肌酐(mg/dL))
重要不良反應
骨髓抑制、溶血性貧血:可能發生重度骨髓抑制如全血細胞減少、粒細胞減少(癥狀:發熱、咽痛和全身不適)、白細胞減少、貧血及血小板減少(發生率如上)和溶血性貧血(發生率不明),須密切觀察。如發現異常,應采取停藥等必要措施。
彌散性血管內凝血(DIC):因可能出現DIC(0.4%),應密切注意患者狀況。如血小板計數,血清FDP和血漿纖維蛋白原等血液學檢查發現異常,須停藥并采取必要措施。
暴發性肝炎等嚴重肝功能異常(發生率不明)(詳見【警告】)。
脫水:可能因嚴重腹瀉導致脫水(發生率不明),須密切觀察。如發現異常,須停藥并采取補液等相應措施。
重度腸炎:可能發生重度腸炎(0.5%),須密切觀察。若發生嚴重腹痛、腹瀉等癥狀,須停藥并采取相應措施。
間質性肺炎*:可能發生間質性肺炎(0.3%) (早期癥狀:咳嗽、氣短、呼吸困難和發熱),須密切觀察。如發現異常,須停藥并進行胸部X光檢查和給予腎上腺皮質激素等相應措施。
重度口腔炎、消化道潰瘍、消化道出血和消化道穿孔:可能發生嚴重的口腔炎(發生率不明)、消化道潰瘍(0.5%)、消化道出血(0.3%)和消化道穿孔(發生率不明),須密切觀察。如發現異常,須停藥,根據需要進行腹部x光等檢查,并采取相應措施。
急性腎功能衰竭:可能發生嚴重的腎臟疾病如急性腎功能衰竭(發生率不明),須密切觀察。如發現異常須停藥并采取相應措施。
Steven-Johnson綜合征和中毒性表皮壞死癥(Lyell綜合征):可能會發生Steven-Johnson綜合征和中毒性表皮壞死癥(發生率不明),須密切觀察。如發現異常,須停藥并采取相應措施。
腦白質病等神經精神系統異常:可能發生腦白質病(主要癥狀為意識障礙、小腦共濟失調和癡呆樣癥狀等)、意識障礙、定向力障礙、嗜睡、記憶減退、錐體外系癥狀,語言障礙、四肢癱瘓、步態障礙,尿失禁或感覺障礙(發生率均不明),應密切觀察。若出現上述癥狀,須停藥。
急性胰腺炎:可能出現急性胰腺炎(發生率不明),應密切觀察。如果出現腹痛或血清淀粉酶升高,須停藥并采取相應措施。
橫紋肌溶解癥:可能出現橫紋肌溶解癥(發生率不明),癥狀包括肌肉痛、虛弱、CK升高和血/尿嘰紅蛋白升高,須停藥并采取相應措施,并注意防止橫紋肌溶解所導致的急性腎功能衰竭。
嗅覺喪失:可能發生嗅覺障礙(0.1%)、嗅覺喪失(發生率不明),須密切觀察。如發現異常,須停藥并采取相應措施。
(*)對非小細胞肺癌患者進行了間質性肺炎和其他肺部疾病發生率的研究。
藥物上市后在非小細胞肺癌的甩藥研究表明間質性肺炎的發生率為0.7%(11/1669),其它肺部疾病包括放射性肺炎、呼吸困難和呼吸衰竭的發生率為0.7%(21/1669)。
其它不良反應
可能發生下列不良反應,如發現異常,須采取減量或停藥等相應措施。如發現藥物過敏,須停藥并采取相應措施。既往接受過治療的乳腺癌患者的手足綜合征發生率較高(21.8%)。本藥上市后臨床研究發現,不能切除或復發的胃癌患者的溢淚發生率較高(16.0%)。
上述發生率根據本品獲得批準前的單藥臨床試驗結果計算。
不良反應注意事項
曾報告接受替吉奧膠囊治療的患者出現急性白血病(個別病例伴隨白血病前期)或骨髑增生異常綜合征(MDS)。
有極少數患者缺乏氟尿嘧啶代謝酶-二氫嘧啶脫氫酶(DPD),若使用氟尿嘧啶類藥物,則在給藥初期可能出現嚴重不良反應(如口腔炎、腹瀉、造血功能異常和神經系統疾病)。
曾發現腦梗死,但與替吉奧膠囊的因果關系并不確定。
奧替拉西鉀在強酸環境下易分解(犬),而奧替拉西鉀的濃度降低可減弱其抑制消化道不良反應的作用(大鼠),故胃pH值明星降低時有可能導致腹瀉。
犬反復給藥后曾發現球結膜鞏膜色素沉著和角膜云翳。
2. 國內臨床試驗:
結果顯示,與本品有關的不良反應發生率為83.78%,其中主要為血液系統68.47%(白細胞減少的發生率為45.05%,血小板減少的發生率為20.72%,多為Ⅰ、Ⅱ度下降),消化系統46.85%(惡心、嘔吐39.64%、腹瀉7.21%),其他14.41%。本品的血液系統不良反應與替加氟相當,但其消化道反應明顯好于替加氟。
本品相關不良事件的發生率為2.70%,主要表現為輕度的胃腸道出血、紅細胞降低,發生率低于替加氟(3.48%)。孕婦及哺乳期婦女用藥:妊娠或可能妊娠的婦女禁用替吉奧膠囊。[妊娠婦女服用UFT后曾發生新生兒畸形。另外,動物試驗也曾發現致畸作用(妊娠大鼠和家兔連續口服替吉奧膠囊(相當于加氟7mg/kg和1.5mg/kg)發現胎兒內臟異常、骨骼異常和骨化延遲)]。 哺乳期婦女服用替吉奧膠囊時應停止哺乳[尚無臨床資料,但動物(大鼠)試驗發現替吉奧膠囊可經乳汁排泄]。(詳見說明書)兒童用藥:低體重出生兒、新生兒、嬰兒、幼兒和兒童使用替吉奧膠囊的安全性尚未得到驗證[尚無臨床資料。如兒童必須使用替吉奧膠囊,須考慮其對性腺的影響,特別注意不良反應的發生]。老年用藥:由于老年人的生理功能下降,須慎重使用本藥。等。更多關于替吉奧膠囊的使用禁忌與詳細注意事項請查看下列復禾醫藥為您整理的科普文章。